Jelatinin Dönüşümü (Istihala)
“Bilim ve Fıkıh Bakış Açısından”
2 milyar Müslüman nüfusu dünyadaki yaklaşık %30’luk kısmı temsil etmektedir. Müslümanların % 70’lik çoğunluğu Pasifik Asya’da ve %20’si orta doğuda yaşamaktadırlar. Bu rakamın 2030 yılında 2.7 milyarı bulacağı tahmin edilmektedir. Bu durum Helal ürünlere olan talebin artacağı anlamına gelmektedir.
Gıda endüstrisi, Müslüman toplumlar için en önemli alanlardan birisidir. Gıda teknolojilerindeki hızlı gelişme çeşitli gıda maddeleri ve onların katkı maddelerini ortaya çıkarmıştır. Pekçok gıda maddeleri şüpheli kaynaklardan elde edilebilmektedir. Ayrıca, Müslüman tüketicilerin farkındalığının istenilen düzeyde olmaması, pazarda Helal gıda ürünlerini bulmadaki zorluğu beraberinde getirmiştir. Gıda endüstrisinde önde gelen tartışmalı konulardan biriside jelatindir.
Jelatin, sığır, tavuk, domuz ve balık gibi hayvanların deri, kemik ve bağ dokularından ekstrakte edilen kollajenin kısmi hidrolizi sonucunda üretilen protein ve peptin karışımıdır.
Önemli teknolojik ve fonksiyonel özelliklerinden dolayı gıda, ilaç, kozmetik ve fotoğrafçılıkta yaygın olarak kullanılan bir biopolimerdir. Gıda endüstrisinde şekerlemelerde ( çiğnenebilirlik, kıvam ve köpük dengeleyici özelliği), süt ürünlerinde ( yoğunlaştırıcı), pastacılıkta (emülsiyonlaştırıcı, jelleştirici ve kıvam arttırıcı) ve et ürünlerinde (su bağlayıcı) özelliklerinden dolayı yaygın olarak kullanılır. (Johnston-Banks, 1990; Schrieber & Gareis, 2007).
Global Jelatin talebi yıllar geçtikçe artmaktadır. Son çıkan raporlara göre yıllık senelik jelatin üretimi 326,000 tondur. Bu rakamın %46’sı domuz derisinden, %29.4’lük kısmı sığır derisinden, %23.1’lik kısmı kemikten ve %1.5’lik kısmı diğer kaynaklardan elde edilmektedir (Karim and Bhatt, 2009). Avrupa’da, %80 yenilebilir jelatin domuz derisinden elde edilmektedir (Boran and Regenstein, 2010).
Islam, haram ve şüpheli şeylerin tüketilmesini yasaklamıştır. Kuran-ı Kerimde;
(Leş, kan, domuz eti, Allah’tan başkası adına boğazlanan, boğulmuş, (taş, ağaç vb. ile) vurulup öldürülmüş, yukarıdan yuvarlanıp ölmüş, boynuzlanıp ölmüş (hayvanlar ile) canavarların yediği hayvanlar -ölmeden yetişip kestikleriniz müstesna- dikili taşlar (putlar) üzerine boğazlanmış hayvanlar ve fal oklarıyle kısmet aramanız size haram kılındı. Bunlar yoldan çıkmaktır. Bugün kâfirler, sizin dininizden (onu yok etmekten) ümit kesmişlerdir. Artık onlardan korkmayın, benden korkun. Bugün size dininizi ikmal ettim, üzerinize nimetimi tamamladım ve sizin için din olarak İslâm’ı beğendim. Kim, gönülden günaha yönelmiş olmamak üzere açlık halinde dara düşerse (haram etlerden yiyebilir). Çünkü Allah çok bağışlayıcı ve esirgeyicidir.). (Al-Maidah, 5:3)
Islam alimleri domuzun bütün parçalarının haram olduğu noktasında hemfikirdirler. Alfakhr Alrazi “Islam ümmeti domuzun bütün parçaları haram kılındığı noktasında hemfikirdir”. Al Kurtubi ” Islam ümmeti domuzun etinin haram kılındığından hemfikirdir. Ibn Hazm” domuza ait olan herşeyin ister et, yağ, deri, bağ doku, beyin, kemik, süt, saç, vs.
Genellikle, pek çok Müslüman fıkıhçı kabul edilen ve kesilen hayvanlardan elde edilen jelatinin helal olduğunu kabul etmişlerdir. Alimler yasaklanan kaynaklardan elde edilen jelatinin haram olduğunda hemfikirdir. (Hammad, 2004).
Fıkıhta istihale ” kirlenmiş veya yasaklanmış bileşenin doğasının tamamen değişmesiyle isim, özellik ve karakter olarak farklı bir ürünün oluşması” olarak tanımlanır. Istihale aynı zaman fiziksel ve kimyasal olarka tamamen bir dönüşüm olarak belirtilir. (Aizat & Radzi, 2009).
Ibn Abdeen belirttiğine göre “başkalaşma maddenin doğasının dönüşümü gerçekleşir”. Sonra bir örnek vermiştir ” tüm bu örnekler maddenin sadece özelliğinde değil, doğasındada bir değişimin olduğunu göstermiştir”.
Dr. Hamed Jami 9. Medikal Fıkıh Sempozyumunda dönüşümün kriterleri ile ilgili ” Islami açıdan dönüşümün kriterleri maddenin doğasının tamamen değişmesi, karakter ve özelliğinin değişerek yeni bir maddenin oluşması, dönüşen materyalin bir orjinal maddeden farklı özelliklere sahip olması gerekmektedir.”
Dönüşüm ile ilgli en ünlü örneğin şarabın (etanol) sirkeye (asetik aside) dönüşmesidir. Bildiğiniz gibi etanol alkol grubundadır ancak dönüşülen materyal (asetik asit) asit grubuna aittir. Bu fiziksel ve kimyasal olarak tam bir dönüşümün olduğu anlamına gelmektedir ve maddenin sadece karakteristik dönüşümünün değil doğasında da tam bir dönüşümün olduğunu görebiliyoruz.
Kollajenin Jelatine dönüşümünü değişim olarak görebilir miyiz??!!
Kollajenin bazı kimyasal ve fiziksel özellikleri değişmektedir ancak bu tam bir dönüşüm değildir.
Jelatin Üretimi:
İki temel Jelatin üretimi vardır:
A tip Jelatin: Ham madde (çoğunlukla domuz derisi) 24 saat işleme tabi tutulur. Bu işlem asitle muamele edilmesini kapsar. Bu aşamadan sonra, jelatin ekstrakte edilebilir.
B Tip Jelatin: Ham madde (ya kemik yada sığır derisi) alkali ile haftalarca muamaleye tutulur. Kollajen daha sonra ılık suda ekstrakte edilebilir.
JELATİN ÜRETİMİ
1.Ön İşlemler
2.Ekstraksiyon(Çekme,Çıkarma)
1.Ön İşlemler
Ham maddenin tam olarak temizliğinden sonra, ham maddenin kökenine bağlı olarak uygulanan farklı ön hazırlık işlem adımlarını içerir.
Ham maddenin hazırlanması
Jelatin üretiminde, prensip olarak iki işlem metodu kullanılır:
Asit işlem metodu-A tipi jelatin için
Ham madde(öncelikle domuz derisi) İlk olarak bir üç günlük hazım işlemine tabi tutulur. Burada malzeme asitle muamele edilir ve hemen sonra jelatin çıkartma işlemine başlanabilir.
Alkali işlem metodu-B tipi jelatin için:
Bu işlem, birkaç haftalık bir zaman periyoduna yayılır ve sakin bir şekilde kollagen yapısını değiştirir. Burada yalnız kemik ve deri parçaları kullanılabilir. Bu yolla üretilen Kollagen sıcak suda erimiş şekildedir.
1.Ekstraksiyon
Ön işlem görmüş malzemeye daha sonra sıcak su ilave edilir ve çok kademeli ekstraksiyon işlemi başlatılır. Düşük sıcaklıkta elde edilen ilk jelatin fraksiyonları en yüksek derecede gelleşme konumuna sahiptir. Yaklaşık %5 lik solüsyon elde edilir. Malzeme,daha sonra taze ve sıcak su kullanarak ekstarksiyon işlemine tabi tutulur. Bu işlem, jelatinin en küçük parçasının kaynar su kullanılarak ekstraksiyonu yapılıncaya kadar devam eder. Tamama çok yakın olarak ekstraksiyon sonucu ürün elde edilir.
Ekstraksiyon
2.Arıtma
Ekstraksiyon işleminden elde edilen yaklaşık %5 lik jelatin solisyonu, yüksek performanslı seperatörlerin kullanımı ile yağ ve lif artıklarından arındırılır. Ön arıtma, temizleyici kiselgurdan geçirilmesi ile tamamlanır.
Ön tabakalama filtreleri ki, azami derecede ince partikülleri tutmayı sağlarlar ve arkasından meşrubat sanayiinde kullanılana benzer sellüloz plaka filtrelerinden geçirilir. Arıtılmış malzeme daha sonra iyon alıp veren reçine içeren kolonlardan geçirilirken, şartlara bağlı olarak, kalsiyumdan,sodyumdan, asit artıklarından ve diğer tuzlardan, jelatin serbest hale getirilir.
Arıtma
3.Konsantrasyon:
Ön ısıtma donanımlı çok kademeli vakum evaparatorler, jelatin solüsyonunu sterilize etmek için kullanılır. Aynı zamanda enerjinin minimum kullanımı ile, seyreltik çözeltiden yumuşak bir tarzda su uzaklaştırılarak bal kıvamında bir konsantre elde edilir. Yüksek viskoz özellikteki solüsyon, daha sonra tekrar selüloz plakalardan oluşan filtrelerinden geçirilir. Herhangi kalmış kalıntılar da uzaklaştırılmış olur.
Konsantrasyon
4.Öğütme, Eleme ve Harmanlama:
Bunlar son işlemlerdir ancak, müşterinin özel istekleri veya farklı uygulamalar için jelatinin önceden hazırlanmasını gerektiren zincirde çok önemli adımlardır. Bu şartlar sebebi ile farklı öğütücüler ve blenderler kullanılır. Silolara doldurulduktan sonra kalite kontrol laboratuarı tarafından son kontroller yapılır çuval, torba ve kutularda ambalajlanarak müşteriye gönderilir.
Asit ve alkali ile muamelesi sonucunda proteinin üçüncül yapısındaki proteinlerin hidrojen bağları ve peptid bağlarında kopmalar meydana gelir. Bu proteinlere suda çözünürlük ve düşük molekül ağırlığı özelliğini verir. Proteinin birincil ve ikincil yapısında bir değişme olmamaktadır. Bir diğer ifadeyle, proteinin heliks yapısında bir değişme olmadığı gibi kimsayal kompozisyonu belirleyen amino asitlerin dizilimindede bir değişme bulunmamaktadır. Ayrıca, bizler hangi tür hayvan olduğunu analizle belirleyebiliriz.
Proteini anlayabilmemiz için proteinin yapısını bilmemiz gerekmektedir:
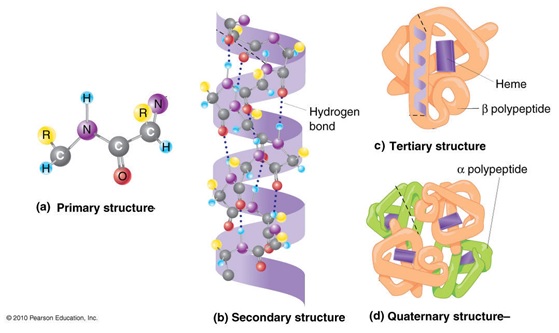
Proteinlerin Yapısal Organizasyonu
- Proteinlerdeki çeşitliliğin başlıca nedeni 4 farklı hiyerarşik yapısal organizasyonun bulunmasıdır
- Birincil (Primary) yapı: proteini oluşturan polipeptidin amino asit dizisi
- İkincil (Secondary) yapı: birincil yapının oluşturduğu belli şekildeki katlanmalar
- Üçüncül (Tertiary) yapı: Farklı ikincil yapıları içeren proteinin 3 boyutlu yapısı
- Dördüncül (Quaternary) yapı: Üçüncül yapıya sahip birden fazla polipeptid zincirinin bir araya gelerek oluşturduğu fonksiyonel proteinler
Proteinlerin Birincil Yapısı
- Proteini oluşturan polipeptid zincirinin amino asit dizilimidir
- Amino asitler birbirlerine kuvvetli ve kararlı peptid bağlarıyla bağlıdırlar
- Bir proteinin birincil yapısı diğer üst yapıları da (ikincil, üçüncül vb.) ve dolaysıyla proteinin fonksiyonunu da belirler
- Birincil yapı genetik düzeyde kontrol edilir
- Bir proteinin amino asit dizilimi aslında onu kodlayan genin DNA dizilimine bağlıdır
Proteinlerin İkincil Yapısı
- Birincil yapının oluşturduğu lokal katlanmalar sonucu oluşan belirli şekildeki yapılardır
- En yaygın ikincil yapı çeşitleri alfa heliks ve beta plakalı tabakalar
- Alfa heliks yapısında her dört amino asit arasında hidrojen bağları vardır, bir tam döngüde 3.6 amino asit bulunur
- Beta plakalı tabakalar paralel veye anti-paralel olabilir
- Ayrıca tesadüfi kıvrımlı yapılar da (random coil) ikincil yapılar içerisinde değerlendirilir
Proteinlerin Üçüncül Yapıları
- Tek bir polipeptid zincirinin (monomer) alabileceği en ileri 3 boyutlu geometrik şeklidir
- İkincil yapılar kıvrılıp bükülerek üçüncül yapıyı oluştururlar
- Üçüncül yapıyı amino asit yan zincirleri (R grupları) arasındaki etkileşimler belirler
- Bu etkileşimlerin en kuvvetlisi kovalent bağ olan disülfit bağlarıdır:
iki sistein amino asit arasında kükürtlerin birbirine bağlanmasıyla oluşur
- Bunun yanında hidrojen bağları, iyonik bağ/tuz köprüleri ve hidrofobik etkileşimler de üçüncül yapının oluşması ve kararlı kalmasına katkı sağlar
Kollajen ve Jelatin arasındaki farklar
Globüler proteinlerin aksine, doğrusal fiber benzeri bir yapıya sahip olan kollajen moleküllerinin en belirgin özelliği, üç polipeptid alt biriminden oluşan büklümlenmişkangal şeklindeki üçlü sarmal yapılarıdır. Kollajen proteinin yapıtaşlarısayılan ve polipeptid alt birimlerden oluşan α-zincirler, bir ortak eksen etrafında dönerek 3000 Ao uzunluğunda ve 15 Ao çapında katıbir çubuk benzeri moleküller oluştururular. Bu zincirler, mikro fibrilleri, mikro fibriller makro fibrilleri ve daha sonra da makro fibriller bir araya gelerek kollajen fiberlerini meydana getirirler. (Asghar & Henrickson, 1982).
Jelatindeki aminoasit kompozisyonu ve dizilimi bir kaynaktan diğerine farklılık göstermesine rağmen, herzaman glisin, prolin ve hidroksiprolin (Gilsenan, and Ross-Murphy, 2000). Jelatin aminoasit dizilimi Gli-X-Y şeklinde tekrarlanmaktadır, X ve Y çoğunlukla sırasıyla prolin ve hidroksiprolin olmaktadır. Kuru jelatinin %25’i prolin ve hidroksiprolin yapıyı dengelemek için bulunmaktadır. (Russell et al., 2007). Amino asit içeriği bakımından,jelatin ile kollajen hemen hemen birbirinin aynıdır. (Djabourov M, Lechaire JP, Gaill F 1993) Kollajen kompozisyonu 20 aminoasit tarafından çevrelenmiştir. Jelatinde sayıca fazla olan aminoasitler Glisin, prolin ve hidroksiprolindir (Schrieber & Gareis, (2007).
Sonuç
Sonuç olarak, domuzdan kaynaklı ürünlerde istihalenin olduğunu düşünmek kabul edilemez. Fıkıhçılara göre “Aksi ispat edlebilecek şey şüphelidir”.Domuz ve yan ürünleri necis olduğundan dolayı, domuzdan elde edilen jelatinde temiz değildir ve gıda, kozmetik ve ilaçlarda kullanımı uygun değildir.
REFERENCES
Kami Büyüközer H. and Sakr A. (2011). Jelatin, Jelatin Uretimi
Asghar, A., & Henrickson, R. L. (1982). Chemical, biochemical, functional, and nutritional characteristics of collagen in food systems. In: Advances in food research, vol.28. London: Academic Press. pp. 232–372.
Boran, G., & Regenstein, J. M. (2010). Chapter 5. Fish gelatin. Advances in Food and Nutrition Research, 60, 119–143.
Collagen as food. Advances in meat research, vol. 4 (pp. 209–222). New York: Van Nostrand Reinhold Company, Inc.
Djabourov M, Lechaire JP, Gaill F.Structure and rheology of gelatin and collagen gels. Biorheology. 1993 May-Aug; 30 (3-4):191-205.
Djabourov, M., Lechaire, J., & Gaill, F. (1993). Structure and rheology of gelatin and collagen gels. Biorheology, 30, 191–205.
Gilsenan, P. M., & Ross-Murphy, S. B. (2000). Rheological characterizations of gelatins from mammalian and marine sources. Food Hydrocolloids, 14,191-195.
Gomez-Guillén, M. C., Turnay, J., Fernndez-Diaz, M. D., Ulmo, N., Lizarbe, M. A., & Montero, P. (2002). Structural and physical properties of gelatin extracted from different marine species: a comparative study. Food Hydrocolloids, 16(1), 25-34.
Johnston-Banks, F. A. (1990). Gelatin. In P. Harris (Ed.), Food gels (pp. 233–289). NewYork: Elsevier Applied Sciences.
Karim, A.A. and R. Bhat, 2009. Fish gelatin: Properties, challenges and prospects as an alternative to mammalian gelatins. Food Hydrocolloid, 23: 563-576.
- J. Aizat & C.W. J. W. M. Radzi. Theory of Istihalah In Islamic and Science Perspective: Application For Several Food Processing Products. Jurnal Syariah. 2009, 17, (1): 169-193
- Hammad. al-Mawad al-Muharramah wa al-Najisah fi al-Ghiza’ wa al-Dawa’ bayna al-Nazariyyah wa al-Tatbiq. Syria. Dar al-Qalam. 2004. pp. 16.
- Schreiber, H. Gareis. The raw material ‘Ossein’. In. R. Schreiber and H. Gareis.(eds.). Gelatine Handbook-Theory and Industrial Practice. Weinham, Wiley-VCH. 2007. pp. 63-71
Russell, J. D.; Dolphin, J. M. and Koppang, M. D. 2007. Selective analysis of secondary amino acids in gelatin using pulsed electrochemical detection. Analytical Chemistry 79: 6615-6621.
Stainsby, G. (1987). Gelatin gels. In A. M. Pearson, T. R. Dutson, & A. J. Bailey (Eds.),
Zhou, P. and Regenstein, J. M. 2006. Determination of total protein content in gelatin solutions with the Lowry or Biuret Assay. Journal of Food Science 71 (8), 474-479.